 Lehrstoffverteilungen für
Fachkunde |
Elektrotechnik |
Fachzeichnen |
Laborübungen
Lehrstoffverteilungen für
Fachkunde |
Elektrotechnik |
Fachzeichnen |
Laborübungen Fragen
FragenWMK-Werkstoffeigenschaften
[FK/EMT]
Chemische Verbindungen
Ionenbindung
Durch Aufnahme oder Abgabe von Valenzelektronen entstehen aus Atomen Ionen. Unterschiedlich geladene Ionen halten sich gegenseitig fest.
Beispiel einer Ionenbindung ist das Kochsalzmolekül:
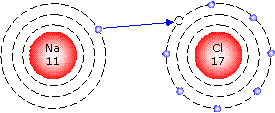
In Wasser wird das Molekül gespalten und das Na-Atom verliert sein Elektron an das Cl-Atom. Ionen sind in Flüssigkeiten frei beweglich.
Atombindung
Die Valenzelektronen benachbarter Atome schließen sich zu Elektronenpaaren zusammen. Die Atome werden durch eine gemeinsam gesättigte Außenschale zusammengehalten.
Beispiele sind C-H-Verbindungen oder Halbleiter.
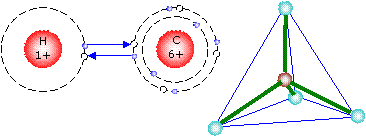
Dabei entstehen erst bei hohen Temperaturen freie Ladungsträger.
Metallbindung
Metallatome werden in einem Gitter zusammengehalten. Die Valenzelektronen bleiben dabei frei.
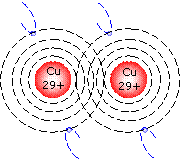
Kennzeichen der Gitterbindung sind die hohe elektrische Leitfähigkeit und Wärmeleitung und der Metallglanz.
Zustandsformen der Stoffe
Sie sind von der Umgebungstemperatur und vom Umgebungsdruck abhängig, und werden wie folgt bezeichnet:
- fest
- flüssig
- gasförmig
- plasmaförmig (Plasma = hocherhitztes Gas, wobei die Atome keine Elektronenhülle mehr besitzen;)
Die Zustände eines Stoffes wirken sich auf den Atomaufbau aus. Da Teile eines Atoms aber Träger der elektrischen Ladung sind, und bewegte Ladungen nichts anderes als Elektrischer Strom ist, ist der Zustand der Stoffe für die elektrischen Eigenschaften von großer Bedeutung.