 Lehrstoffverteilungen fĂĽr
Fachkunde |
Elektrotechnik |
Fachzeichnen |
LaborĂĽbungen
Lehrstoffverteilungen fĂĽr
Fachkunde |
Elektrotechnik |
Fachzeichnen |
LaborĂĽbungen Fragen
FragenGET-Chemische Stromwirkung
[EAM/EMT]
Strom in Flüssigkeiten
Stromleitende Flüssigkeiten nennen wir
Durch die Spaltung der Moleküle in Wasser (Dissoziation) entstehen positive Metall-Ionen und negative Säurerest-Ionen (Hydroxide). Bei der Auflösung von Kupfer-Sulfat (
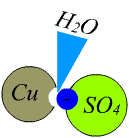
Die so entstandenen Ionen können sich als Materieteilchen frei in der Flüssigkeit bewegen.
Elektrolyse
"Badet" man in einem Elektrolyten zwei Elektroden, die man unter Spannung setzt, fließt ein Strom, der gleichzeitig Materie transportiert.
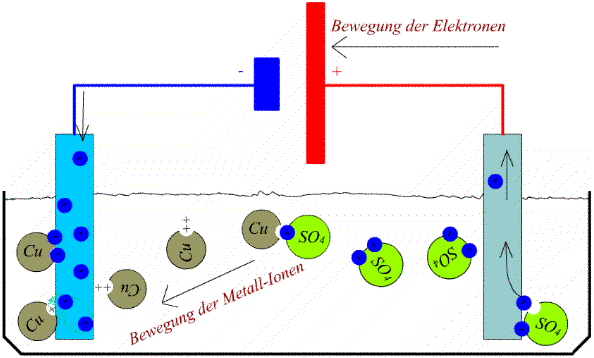
Durch die Ablagerung der Kupfer-Ionen an der Kathode, wird diese mit einer Kupferschicht überzogen. Je nach Zeitdauer kann die Schicht dicker oder dünner ausfallen.
Stoffabscheidung nach Faraday
Die Verkupferung der Kathode zeigt ein Beispiel der Elektrolyse, bei der eine bestimmte Stoffmenge (Cu) aus einem Elektrolyten abgeschieden wird. Dadurch wird die Lösung (H2O + CuSO4) natürlich wässriger und die Kathode immer schwerer.
Das Gewicht der elektrolytisch abgeschiedenen Stoffmenge, oder die Gewichtszunahme der Kathode, kann mit dem Gesetz von Faraday berechnet werden:
![]()
Die abgeschiedene Stoffmenge in ergibt sich aus dem Produkt
- der Tabellenzahl (elektrochemisches Äquivalent) in
- des Nutzstromes in und
- der Einschaltzeit in :
Tabelle für einige Stoffwerte:
| Stoff | Elektrochemisches Äquivalent c in g/Ah |
Stromausbeute in % |
|---|---|---|
| Aluminium | 0,335 | - |
| Chrom | 0,647 | 15 |
| Gold | 2,452 | 90 |
| Kupfer | 1,186 | 100 |
| Silber | 4,025 | 100 |
| Sauerstoff | 0,299 | 100 |
Dabei gibt die Stromausbeute an, wieviel % des fließenden Stromes tatsächlich Stoff abscheidet (= Nutzstrom), also genutzt werden kann. Es gilt für die Berechnung der Stoffmenge:
![]()